¿Es posible que continúen las dudas sobre la seguridad y eficacia de una vacuna que lleva administrándose más de 10 años en todo el mundo? Pues eso está pasando con la vacuna del VPH.

Hace poco nos hacíamos eco de una revisión sobre su eficacia publicada el el JRSM en enero de este año:
«Esta revisión ha revelado muchos problemas metodológicos con los ensayos de eficacia de Fase 2 y 3 de la vacuna contra el VPH, lo que genera incertidumbre con respecto a la comprensión de su eficacia»
Acaba de publicarse la revisión sistemática y meta-análisis de Lars Jørgensen, Peter C. Gøtzsche y Tom Jefferson que analiza más específicamente los problemas de seguridad de la vacuna. Hasta el momento, las seguridad se ha valorado mediante los datos publicados en las revistas científicas:
Una revisión Cochrane de 2018 y la mayoría de los grandes estudios epidemiológicos no han encontrado daños graves asociados con las vacunas contra el VPH. La revisión Cochrane se basó principalmente en publicaciones de revistas, a menudo influenciadas por el sesgo de información, y en estudios epidemiológicos, con muchos factores de confusión.
Mientras los grandes estudios «oficiales» y las revisiones institucionales descartan problemas de seguridad relevantes relacionados con las vacunas del VPH, siguen apareciendo informes de casos que vinculan la vacuna con eventos adversos, raros pero graves:
«Los daños serios y poco comunes reconocidos incluyen anafilaxis y síncope. Algunos estudios de casos han informado de daños neurológicos raros como el síndrome de taquicardia ortostática postural (POTS) y del síndrome de dolor regional complejo (CRPS). Los análisis de grupo de los informes de seguridad de casos individuales de VigiBase® de la Organización Mundial de la Salud (OMS) revelaron daños adicionales, a menudo de naturaleza grave, que se superponían con la sintomatología del POST y el CPRS. Aunque la investigación de la Agencia Europea del Medicamento no encontró una asociación de estos efectos con las vacunas contra el VPH, esta investigación se basó en las propias evaluaciones de los fabricantes de las vacunas que no registraron unos 30 casos de POTS y CRPS. Otros daños raros que se han comunicado incluyen el síndrome de fatiga crónica (SFC), el síndrome de Guillain-Barré (SGB) y la insuficiencia ovárica prematura (FOP).»
¿Son fiables los datos que se están manejando para evaluar la seguridad de la vacuna del VPH? Pues no lo son por varios motivos:
(1) Los ensayos clínicos son diseñados, desarrollados y los datos analizados por la propia industria farmacéutica. Los ensayos clínicos pivotales de la vacuna del VPH además se han realizado en países en vías de desarrollo con importantes problemas de gobernanza y regulación
(2) Solo acaban publicados los ensayos clínicos que la industria desea publicar que son los que luego se sintetizan en meta-análisis y revisiones sistemáticas que posteriormente son utilizadas para las Guías de Práctica Clínica

(3) Los artículos científicos que comunican los resultados son elaborados mayoritariamente por empresas profesionales de escritura científica que acaban trasmitiendo lo que quieren trasmitir los pagadores
(4) Los sistema de control post-comercialización para la detección de eventos adversos también están dominados por la industria

Como dice David Healy en su último libro (el primero traducido al castellano), «La decapitación del cuidado»:
«Durante tres décadas, la mayor concentración de “fake news” en el planeta se ha producido en la información sobre los medicamentos que los médicos prescriben (de hecho, la literatura científica está mayoritariamente escrita por ghostwriters o escritores fantasma). Nadie, ni siquiera los reguladores, tiene acceso a los datos de los ensayos clínicos que son utilizados, literalmente, para que nos traguemos las indicaciones de las medicinas»
Entonces, ¿existen fuentes fiables accesibles para poder analizar la efectividad y la seguridad de los medicamentos y vacunas?

Desde luego los Clinical Study Reports (CSR) o informes que la industria remite a las agencias regulatorias, muy extensos y exhaustivos, parecen más informativos que los ensayos clínicos publicados. Se calcula que por cada página de artículo en una revista, puede haber hasta 8000 páginas de datos regulatorios sobre el mismo ensayo clínico.

Dos de los autores del estudio que estamos comentando sobre las vacunas del VPH escribieron este importante editorial en el BMJ EBM donde pedían cambiar el criterio para definir evidencia, pasando de los ensayos clínicos publicados a los CSR.
Pues bien, Lars Jørgensen y Tom Jefferson, junto con Peter C. Gøtzsche acaban de publicar el análisis más extenso realizado sobre la seguridad y eficacia de la vacuna del VPH basándose en las mejores evidencias existentes: los datos que se encuentran en los CSR, en poder de las agencias reguladoras.

Tras un proceso de indexación de ensayos clínicos publicados y no publicados así como revisión de los CSR en poder de la EMA, se revisan y sintetizan los datos encontrados.
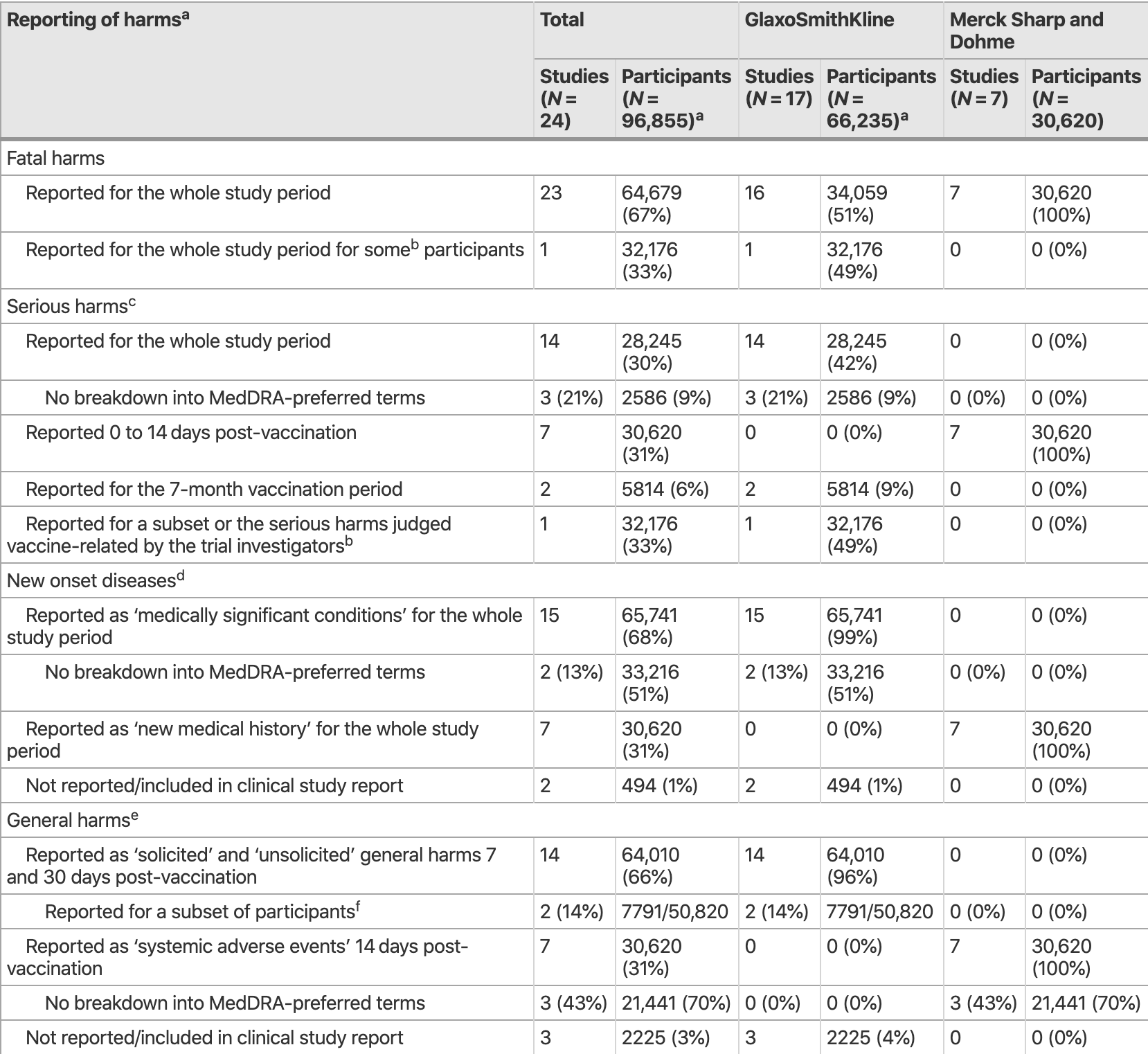
Gracias a poder acceder a los CSR los investigadores pueden detectar eventos adversos que después no son divulgados en los artículos científicos por considerarlos no agrupables o estar más definidos:
«Los informes de los estudios clínicos incluyeron más de 3000 tipos diferentes de daños que se clasificaron con los términos del MedDRA (Diccionario Médico para las Actividades de Reglamentación). Los daños se notificaron a menudo de forma incompleta y heterogénea»
El estudio fue exhaustivo, incluyendo ensayos clínicos y CSR:
«Identificamos 50 estudios elegibles: 43 ensayos de la industria, 5 estudios de seguimiento de la industria y 2 ensayos ajenos a la industria. Obtuvimos 24 CSR con 58.412 páginas de la EMA y GlaxoSmithKline para 22 ensayos de la industria y 2 estudios de seguimiento de la industria (17 Cervarix™, 5 Gardasil™, 1 Gardasil 9™ y 1 vacuna monovalente contra el VPH de tipo 16 de Merck) con un total de 95.670 participantes (79.102 mujeres y 16.568 hombres de edades comprendidas entre los 8 y los 72 años) y 393.194 personas-año. Los 24 informes de estudios clínicos incluyeron el 79% (95.670/121.441) del total de la muestra elegible de los 50 estudios elegibles identificados»
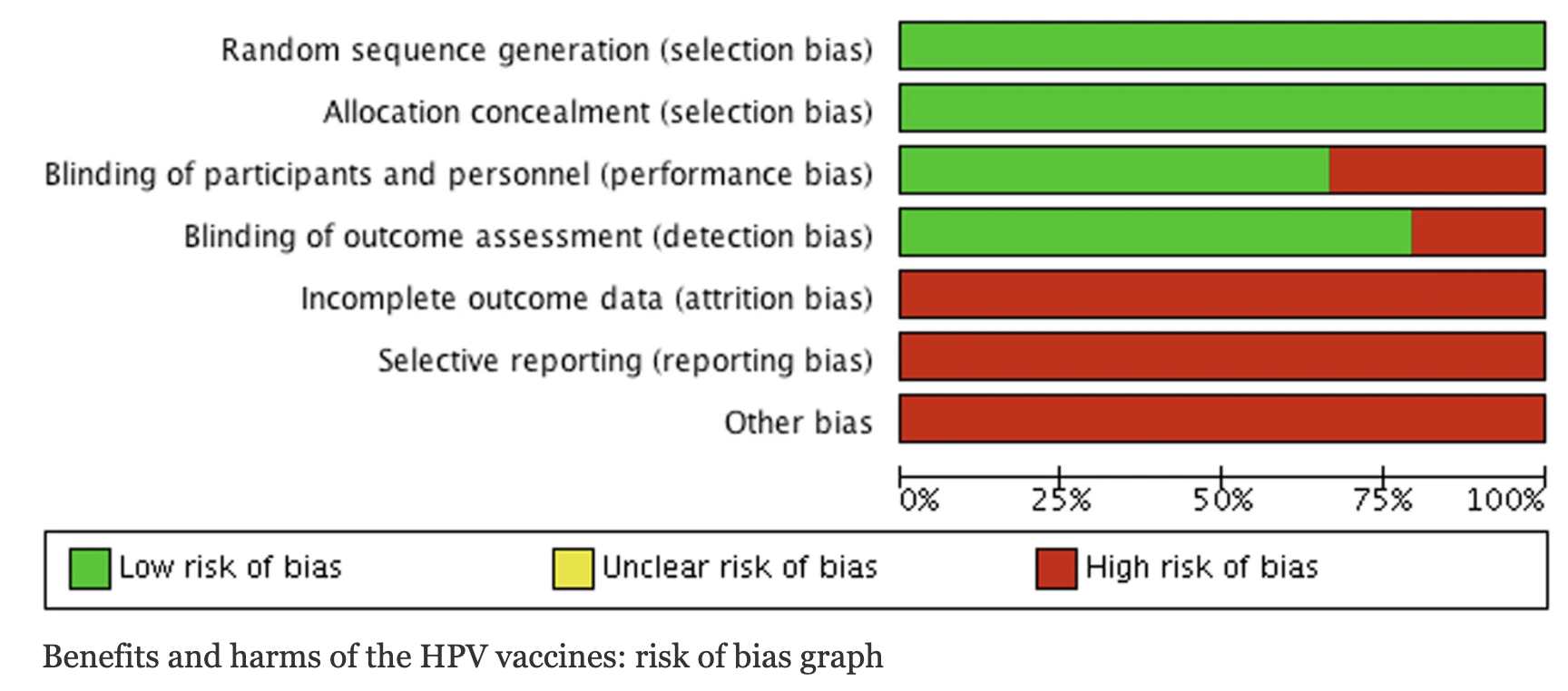
RESULTADOS
Se trata del primer estudio sobre la vacuna del papiloma con los datos de los CSR. Sin embargo, a pesar de los esfuerzos de los investigadores, el acceso fue insuficiente:
«Hubo acceso insuficiente a los datos de los ensayos; la presentación de los CSR fue incompleta; los datos están fragmentados; hay períodos de seguimiento muy cortos…. Se necesitaron 3 años para poder obtener un subconjunto incompleto de los CSR elegibles… La inclusión de los participantes pertenecients a los 26 estudios sin CSR fue de solo una quinta parte del total de participantes elegibles, lo que podría haber influido en nuestra revisión, ya que algunos de nuestros resultados tenían valores de P alrededor de nuestro límite de 0,05 e intervalos de confianza que eran amplios.»
(1) Eficacia: Hay datos de eficacia prometedores:
Nuestro examen sistemático de 24 CSR con 95.670 participantes demostró que las vacunas contra el VPH, en los cuatro años siguientes de seguimiento, disminuyeron el carcinoma in situ relacionado con el VPH, que tiene una alta probabilidad de progresar a cáncer; también los procedimientos de tratamiento relacionados con el VPH
Sin embargo, estos datos positivos tienen limitaciones. Algunas son:
+ El seguimiento prolongado no fue posible para el 75% de los participantes del grupo control (36.344/48.595), ya que se les ofreció la vacuna contra el VPH al finalizar el ensayo.
+ Tres ensayos -HPV-008, V501-013 y V501-015- con el 38% (36.266/95.670) de los participantes analizados, se interrumpieron de forma anticipada, cuando la neoplasia intraepitelial del cuello uterino relacionada con el VPH (CIN2+) se redujo significativamente. Sabemos que cuando los ensayos se interrumpen antes de tiempo, se exageran los beneficios un promedio del 29% en comparación con los ensayos completados de la misma intervención. Cuando estos tres ensayos fueron excluidos de nuestro meta-análisis el número de lesiones CIN2+ no se redujo significativamente
+ En un CSR (HPV-015) sólo se informó de los CIN2+, aunque hubo tres casos de cánceres relacionados con el HPV en el grupo de la población vacunada y uno en el grupo control. Estos cánceres son etiquetados como daños graves pero no se mencionaron en ninguna otra parte del iCSR. En aras de la transparencia, habría sido más apropiado informar de cada resultado histológico (cáncer, carcinoma in situ, neoplasia intraepitelial moderada, etc.) que sólo un resultado sustitutivo compuesto como el CIN2+.
+ Todos los ensayos clínicos hicieron seguimiento mediante citologías. Esto puede reducir la validez externa por dos razones: (a) en las poblaciones reales las mujeres vacunadas contra el VPH tienden a realizarse menos citologías del cuello uterino (lo cual es lógico; ¿no se trata de eso?); (b) las citologías se realizan con mucha más frecuencia de la recomendada (cada 6 meses) y a menor edad (15-26 años) cuando sabemos que se recomienda citología cada 3-5 años después de los 25 años de edad porque la mayoría de las lesiones CIN2+ en mujeres menores de 30 años presentarán una regresión espontánea (es decir, se detectarán más lesiones en el grupo control, lo que exagerará los beneficios del grupo intervención)
(2) Seguridad: El problema más grave en nuestra opinión está en la seguridad. Debido a la inconsistencia de los datos en los CSR, no es posible obtener una idea exacta de los eventos adversos. Globalmente se informó de manera incompleta de daños graves en el 72% de los participantes (68.610/95.670). Aunque los autores concluyen que «las vacunas aumentaron los trastornos graves del sistema nervioso (análisis exploratorio) y los daños generales» especifican que son datos probablemente inexactos o «exploratorios»:
«Algunos CSR informaron de cifras agregadas de los daños, clasificados por órganos mediante el sistema MedDRA…Por lo tanto, puede incluir a un participante más de una vez. Por eso, consideramos que estos análisis son exploratorios».
Es decir, mientras las autoridades aseguran que la vacuna del papiloma es segura sin ninguna duda, cuando los investigadores acceden a la documentación más completa sobre seguridad, se encuentran con que solo pueden hacer un análisis exploratorio debido a los numerosos sesgos e inconsistencias.
Los autores ponen un ejemplo:
«El ensayo clínico HPV-008 con Cervarix, informó de todos los daños graves que ocurrieron durante 48 meses de seguimiento. El ensayo V501-015 con Gardasil informó de los eventos graves ocurridos tan solo los primeros catorce días tras la vacunación, con el resultado lógico de ser diez veces menos frecuentes (1664/18.644 frente a 102/12.167). En el ensayo aleatorio por grupos, HPV-040, el 88% (28.473 de 32.176) de los participantes no fueron incluidos por haber reportado daños graves»
Además, otro grave problema para poder conocer los verdaderos efectos adversos de la vacuna es que se utilizó coadyuvante activo en el grupo control lo que «puede haber subestimado los daños relacionados con las vacunas contra el VPH». A pesar de esta evidencia, en los CSR, los formularios de consentimiento informado o las correspondientes publicaciones en revistas se utilizó a menudo el término placebo (que es una sustancia sin efecto activo) para describir comparadores que realmente eran activos y contenían aluminio.
Hay también una preselección de los participantes en los estudios:
«Dos tercios de los participantes (63.468/95.670) sólo se incluyeron en los ensayos si no tenían antecedentes de trastornos inmunológicos o del sistema nervioso».
Tales trastornos no figuran como advertencias o contraindicaciones en los prospectos de las vacunas contra el VPH aprobadas. Por lo tanto, es previsible que el grado de daño sea mayor en la práctica clínica que en los ensayos.
Los datos de daños graves relacionados con los síndromes POTS y CRPS no permiten extraer conclusiones debido a la heterogenicidad del registro. Los autores concluyen:
«Por consiguiente, los análisis no prueban que las vacunas contra el VPH causen POTS y CRPS, pero sí señalan la importancia de que se realicen análisis independientes para descartar relación de la vacunación con los síndromes POTS y CRPS»
CONCLUSIONES
Volvemos a la pregunta inicial ¿Cómo es posible que tras 10 años de vacunación sigan existiendo tantas dudas sobre la efectividad y la seguridad de la vacuna del VPH?
Las dudas existentes no son parte de la incertidumbre que siempre existe en la investigación científica sino que son perfectamente subsanables con más transparencia y acceso a los datos y con mejores diseños de los estudios.
Está claro que la industria no tiene ningún interés en contar con estudios que puedan señalar escasa efectividad o seguridad de sus productos. ¿Cuántos millones de euros están en juego? ¿De verdad alguien cree que las empresas van a poner en riesgo sus retornos económicos permitiendo acceso a lo que consideran son sus datos y con el diseño de estudios de más calidad?
Algo tan evidente no le parece importante a las autoridades que siguen recomendando que se siga vacunando a niñas sanas sometiéndolas a riesgos desconocidos, potencialmente graves, a cambio de dudosos beneficios. Como dicen los autores:
«Dado que los ensayos incluidos estaban diseñados principalmente para evaluar los beneficios y no para evaluar los daños, no está claro en qué medida los beneficios superan a los riesgos. El acceso limitado a los CSR y a los datos de los ensayos con formularios de informes de casos impidió una evaluación exhaustiva. Se necesita una evaluación independiente de los datos completos de cada participante.»

El comentario crítico de Hilda Bastian al texto de Lars Jørgensen, Peter C. Gøtzsche y Tom Jefferson en la misma revista nos genera perplejidad ya que repite los argumentos de los tres investigadores cuando señalan las debilidades de su estudio.
Efectivamente, sin acceso a todos los datos y con estudios de baja calidad, el resultado de analizar los CSR son muy semejantes a los resultados de analizar los estudios publicados.
Efectivamente, el análisis de los efectos adversos es exploratorio y, por tanto, está sometido a posibles errores, precisamente porque en los CSR las descripciones se agrupan de manera heterogénea e incompleta y sin garantías de que sean individualizadas. Estas debilidades ya son señaladas por los autores.
Con todo, increíblemente, para Hilda Bastian el problema es de los autores y no de las dificultades para el acceso a los datos o los diseños defectuosos, que ellos ya señalan en su artículo y describen como debilidades del estudio.
La diferencias es clara: mientras los autores piden más acceso y estudios independientes, es decir, mejor conocimiento, la Dra. Bastian parece contenta con el estado de cosas.

Creemos que la principal conclusión de este trabajo es que la vacuna del VPH no es el Tamiflu. En el caso del Tamiflu, el acceso a los CSR, en una investigación liderada por uno de los autores de este trabajo, el Dr. Jefferson, permitió descartar que este medicamento tuviera alguna utilidad en la gripe.

Con la vacuna del VPH no ha ocurrido lo mismo. Los problemas de acceso y los diseños defectuosos minan los CSR como minaron los resultados de la revisión Cochrane aunque, a diferencia de lo que pasa con Hilda Bastian o los autores de la revisión Cochrane, los investigadores no se quedan satisfechos.
La única conclusión que compartimos con Hilda Bastian es que «los CSR no son sinónimo de datos exhaustivos»
¡Qué cruz!
.

